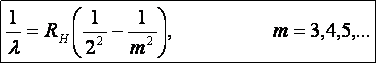
Atomien viivaspektrit havaittiin 1800 -luvun lopulla.
Sveitsiläinen matemaatikko J. Rydberg esitti vedyn spektriviivojen λ: n noudattavan kaava
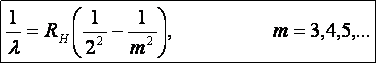
missä RH on Rydbergin vakio = 1,09737 · 107 m-1
Yhtälön avulla voidaan laskea vetyatomin spektriviivojen paikat.
Vetyatomin spektristä löydettiin myöhemmin myös infrapuna (IR)- ja ultraviolettialueelta (UV)- spektrisarjoja. Vetyatomin spektrin kaikkia viivoja vastaavat aallon pituudet saadaan yhtälöstä

Atomien spektrisarjoja nimitetään löytäjiensä mukaan. Kolme ensimmäistä sarjaa ovat
- Lymanin sarja (UV-alueella) n = 1, m = 2,3,4,...
- Balmerin sarja (näkyvä-alue) n = 2, m = 3,4,5,...
- Paschenin sarja (IR-alueella) n = 3, m = 4,5,6,...
Havainnolla oli ratkaiseva merkitys Bohrin atomimallin kehittymiselle.
© Matti K